- Сопряженные системы
В простейшем случае сопряженные системы — это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp гибридизации. Четыре негибридные р орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется π, π сопряжением.
Происходит сопряжение р-электронов с S-электронами. Этот вид сопряжения называется р, π сопряжением. Закрытая система имеется в ароматических УВ.
Сопряжение — процесс энергетически выгодный, энергия (Е) при этом выделяется.
Энергия сопряжения бутадиена — 1,3 составляет 15 кДж/моль, энергия сопряжения бензола — 228 кДж/моль.
- Ароматичность
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
- плоский замкнутый цикл;
- все атомы С находятся в sp2 гибридизации;
- образуется единая сопряженная система всех атомов цикла;
- выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 π электронов, где n = 1, 2, 3...
Простейший представитель ароматических углеводородов — бензол. Он соответствует всем четырем условиям ароматичности.
Правило Хюккеля: 4n + 2 = 6, n = 1.
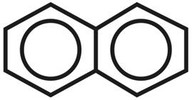
Нафталин — ароматическое соединение 4n + 2 = 10, n = 2.
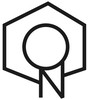
Пиридин — ароматическое гетероциклическое соединение.
Взаимное влияние атомов в молекуле
1861 г. русский ученый A. M. Бутлеров выдвинул положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект — это передача электронного влияния по цепи p связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (d). Такое электронное смещение называется индуктивным и обозначается буквой «I» и стрелкой «→».
δ+ δ –
СН3 → СН2 → X, Х = Ha–l, НО–, HS–, NH–2 и др. Индуктивный эффект может быть положительным или отрицательным. Если заместитель X притягивает электроны химической связи сильнее, чем атом Н, то он проявляет –I.I (H) = 0. В нашем примере X проявляет –I.
Если заместитель X притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН–з, C2H5— и т. д.), Меn+ проявляют +I.
Мезомерный эффект (эффект сопряжения) — это влияние заместителя, передаваемое по сопряженной системе π связей. Обозначается буквой «М» и изогнутой стрелкой. Мезомерный эффект может быть «+» или «–». Выше было сказано, что имеется два вида сопряжения π, π и р, π.
Заместитель, притягивающий электроны из сопряженной системы, проявляет –М и называется электроноакцептором (ЭА). Это заместители, имеющие двойную связь –С =.
Заместитель, отдающий электроны в сопряженную систему, проявляет +М и называется электронодонором (ЭД). Это заместители с одинарными связями, имеющие неподеленную элект ронную пару (–ОН, –NH2, –Nal, –OR и др).
Классификация органических реакций
Химические реакции — это процессы, сопровождающиеся изменением распределения электронов внешних оболочек атомов реагирующих веществ. В результате реакции в реагирующих молекулах веществ разрываются одни химические связи и образуются другие. Реакция идет в сторону образования стабильных частиц, т. е. обладающих меньшей внутренней энергией.
Классифицировать реакции можно по различным признакам.
-
- По типу разрыва химических связей в реагирующих частицах (субстрат и реагент). Субстрат — это реагирующее вещество, реагент — действующее вещество. Данное разделение условное.
Различают три типа реагентов:
1) радикалы (R) — это нейтральные атомы или частицы с не спаренным электроном (Н–, Сl–.–ОН, —СН3 и др.);
2) нуклеофилы (Nu — «любящие ядра») — это частицы, имеющие электронную пару на внешнем электронном уровне атома;
3) электрофилы (Е — «любящие электроны») — это частицы, имеющие недостаток электронов — незаполненный валентный электронный уровень.
В реакциях нуклеофил атакует в субстрате реакционный центр с недостатком электронов, электрофил атакует реакционный центр с избытком электронов. Соответственно этому различают:
1) радикальные реакции;
2) электрофилъные реакции;
3) нуклеофильные реакции.
-
- По количеству и характеру исходных и конечных продуктов различают типы реакций:
1) замещения; они подобны реакциям обмена в неорганической химии;
2) присоединения;
3) отщепления (элиминирования) — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними π связи;
4) перегруппировки.
С учетом характера реагентов реакции замещения и присоединения могут быть нуклеофильными, электрофильными и радикальными и обозначаться следующим образом:
1) реакции нуклеофильного замещения;
2) реакции электрофильного замещения;
3) реакции радикального замещения;
4) реакции электрофильного присоединения;
5) реакции нуклеофильного присоединения;
6) реакции оадикального присоединения.
| 


