Ароматические амины
Методы получения
1) Восстановление ароматических нитросоединений
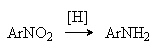
Для восстановления в препаративных целях используют металл (Fe, Zn, Sn) и кислоту, соли металлов в низших степенях окисления (SnCl2, TiCl3), сульфиды щелочных металлов, в промышленности применяют в основном каталитическое гидрирование.
2) Алкилирование
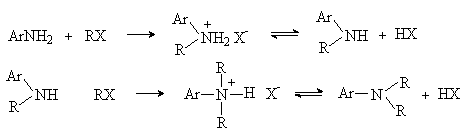
Реакция аналогична алкилированию алифатических аминов. В качестве алкилирующих реагентов используют алкилгалогениды, алкилсульфаты, спирты.
3) Арилирование
Галогенарены реагируют с аммиаком и аминами в жестких условиях. Процесс катализируется медью и ее соединениями.
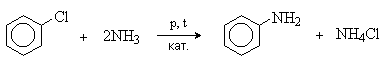
Реакция замещения галогена протекает легче при наличии в орто- и пара-положениях электроноакцепторных групп (NO2, CN).
Галогенарены взаимодействуют с ариламинами в присутствии меди с образованием диариламинов (реакция Ульмана).
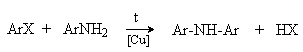
Физические свойства и строение
Ароматические амины – бесцветные жидкости или твердые вещества. При хранении быстро темнеют вследствие окисления кислородом воздуха.
Аминогруппа и ароматическое кольцо образуют сопряженную систему. Аминогруппа проявляет электронодонорные свойства за счет +М-эффекта.
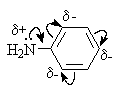
Ароматические амины обладают сильными электронодонорными свойствами, на что указывают низкие энергии ионизации (для анилина 7,7 эВ, для фенола 8,4 эВ).
Химические свойства
Для ариламинов характерны реакции с электрофильными реагентами. Местом атаки электрофила может быть атом азота или ароматическое кольцо.
Основные свойства
Ароматические амины обладают меньшей основностью, чем алифатические амины и аммиак (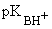 ~ 3 – 5). Причина низкой основности ариламинов – стабилизация свободного амина за счет делокализации неподеленной пары электронов азота по ароматическому кольцу и потеря энергии стабилизации при нарушении сопряженной системы в результате протонирования. ~ 3 – 5). Причина низкой основности ариламинов – стабилизация свободного амина за счет делокализации неподеленной пары электронов азота по ароматическому кольцу и потеря энергии стабилизации при нарушении сопряженной системы в результате протонирования.
Дифениламин и трифениламин имеют еще большие возможности для делокализации пары электронов азота, что приводит значительному снижению основности. Трифениламин практически не обладает основными свойствами.
Введение заместителей в ароматическое кольцо влияет на основность амина. Влияние заместителей проявляется в соответствии с их электронными эффектами.
|
|
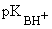
|
|
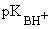
|
|
п-CH3C6H4NH2
|
5,1
|
п-O2NC6H4NH2
|
1,0
|
|
C6H5NH2
|
4,6
|
(C6H5)2NH
|
0,78
|
|
м-O2NC6H4NH2
|
2,5
|
|
|
Реакции с С-электрофилами
Важнейшими реакциями этого типа являются алкилирование и ацилирование, которые протекают по атому азота и аналогичны реакциям алифатических аминов. Ароматические амины менее реакционноспособны из-за меньшей основности атома азота.
Реакции ароматического электрофильного замещения
а) Галогенирование
Аминогруппа является сильным активирующим заместителем и ориентантом I рода. Галогенирование свободных аминов протекает очень легко и часто приводит к полигалоидпроизводным. Например, анилин при действии бромной воды мгновенно превращаются в нерастворимое 2,4,6-трибромпроизводное.
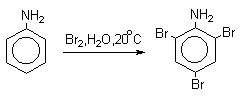
Для получения моногалогенпроизводных активирующее действие аминогруппы снижают путем ацилирования. После снятия ацильной защиты путем гидролиза получают свободный амин.
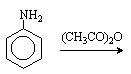 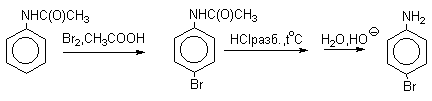
б) Нитрование
При нитровании нитрующей смесью амины окисляются. Кроме того, из-за солеобразования по аминогруппе образуется м-изомер (-NH3+ - ориентант II рода).
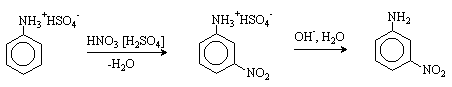
Для введения нитрогруппы в орто- или пара-положение к аминогруппе последнюю защищают ацилированием. Варьируя условия реакций (температуру, нитрующие агенты), можно проводить нитрование региоселективно.
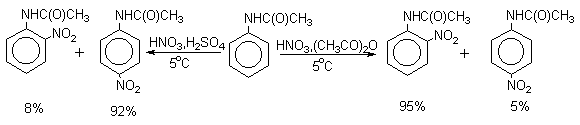
После снятия ацетильной защиты получают свободные орто- и пара-нитроанилины.
в) Сульфирование
Сульфированием ароматических аминов получают аминосульфокислоты. В 90-100%-ной серной кислоте или олеуме амин полностью находится в протонированной форме. Аммониевая группа NH3+как сильный электроакцепторный заместитель вызывает резкое замедление реакции сульфирования и ориентирует замещение в мета-положение.
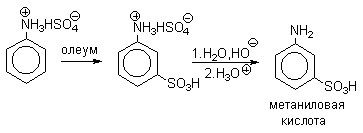
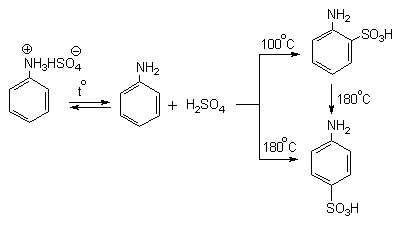
Для получения орто- и пара-аминобензолсульфокислот используют “метод запекания”. Процесс осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200оС в сухом виде или в высококипящих растворителях. При температуре около 100оС образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200оС - пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
Нитрозирование
Первичные ароматические амины с азотистой кислотой образуют относительно устойчивые соли арилдиазония.
ArNH2 + NaNO2 + 2HCl → ArN2+Cl- + NaCl + 2H2O
Эту реакцию называют диазотированием
Вторичные ароматические амины при нитрозировании дают N-нитрозамины.
ArNHR + NaNO2 + HCl → Ar-N(R)-N=O + NaCl + H2O
Третичные ариламины дают продукты нитрозирования в пара-положение ароматического кольца.
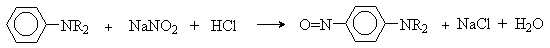
| 


