Одноатомные фенолы.
Способы получения
1) Получение из каменноугольного дегтя. Этот способ является важнейшим техническим способом получения фенолов. Он со стоит в том, что сначала фракции дегтя обрабатывают щелочами. Фенолы, хорошо растворимые в водных растворах щелочей с образованием фенолятов, легко отделяются при этом от углеводородов дегтя, которые в свою очередь не растворяются ни в воде, ни в водных растворах щелочей. Полученные щелочные растворы обрабатывают серной кислотой, которая разлагает феноляты, в результате чего опять выделяются фенолы, например:
C6H5ONa + H2SО4 → NaHSО4 + C6H5OH.
Выделенные фенолы для разделения подвергают повторной фракционной перегонке и дальнейшей очистке.
2) Получение из солей сульфокислот. При сплавлении солей сульфокислот со щелочами образуются фенол и сульфит калия:
C6H5SO3K + КОН → С6Н5ОН + K2SО3.
Образующийся фенол в присутствии КОН превращается в фенолят:
С6Н5ОН + КОН → С6Н5ОК + H2О.
Фенолят далее разлагают серной кислотой, причем образуется свободный фенол:
С6Н5ОК + H2SО4 → С6Н5ОН + KHSO4.
3) Получение из кумола (изопропилбензола). Кумол окисляют кислородом воздуха; образовавшаяся гидроперекись кумола придействии серной кислоты дает фенол и другой ценный продукт — ацетон:
кумол → гидроперекись кумола → фенол.
4) Получение из солей диазония — важный способ введения фенольного гидроксила.
Кумол получают алкилированием бензола пропиленом (выделяемым из отходящих газов крекинга) в присутствии катализаторов (например, АlС13).
Физические свойства
Фенолы в большинстве случаев представляют собой, твердые кристаллические вещества, очень плохо растворимые в воде. Обладают сильным характерным запахом.
Химические свойства
Важнейшим свойством фенолов, отличающим их от спиртов, является их кислотность. Вместе с тем, обладая общей со спирта ми схемой строения (R–ОН), фенолы вступают в некоторые реакции, характерные и для спиртов.
1) Слабокислые свойства. Всем фенолам присущи слабокислые свойства, что проявляется в их способности растворяться в щелочах с образованием фенолята:
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Как известно, спирты практически не реагируют со щелочами, т. е. кислотными свойствами не обладают. Алкоголяты (аналогичные по формуле фенолятам) получаются из спиртов при действии свободных щелочных и щелочноземельных металлов, например металлического натрия:
С2Н5ОН + Na → C2H5ONa + H.
Феноляты получаются при действии на фенолы как ряда свободных металлов, например:
С6Н5ОН + Na → C6H5ONa + Н,
так и едких щелочей:
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Кислотные свойства фенолов выражены очень слабо. Так, фенолы не окрашивают лакмусовую бумагу. Самая слабая неорганическая кислота — угольная — вытесняет фенолы из их солеобразных соединений — фенолятов:
C6H5ONa + H2CO3 → С6Н5ОNa + NaHCО3.
Определения констант диссоциации показывают, что кислотные свойства фенола выражены в 3300 раз слабее, чем у угольной кислоты.
Кислотные свойства фенольного гидроксила (по сравнению со спиртовым) объясняются тем, что в фенольном гидроксиле свободная пара электронов кислорода взаимодействует с π электронами бензольного кольца, сдвигаясь в сторону кольца. Атом кислорода, поскольку его отрицательный заряд уменьшается, а положительный вследствие этого несколько увеличивается, сильнее притягивает к себе электрон от атома водорода гидроксила; это облегчает отщепление водорода в виде протона, т. е. диссоциацию.
Со щелочными металлами реакция идет очень бурно и может сопровождаться взрывом.
2) Образование простых эфиров. Фенолы, подобно спиртам, способны давать соединения типа простых эфиров. Практически для получения простых эфиров фенолов на феноляты действуют галогеналкилами (1) или галогенарилами (2):
C6H5ONa + IC2H → C6H5–О–C2H5 + NaI, (1)
C6H5ONa + Br C6H5 → C6H5–О–C6H5 + NaBr. (2)
В первом случае (1) получается простой эфир, содержащий радикал фенола и радикал спирта, т. е. смешанный жирноароматический простой эфир. Во втором случае (2) получается простой эфир, содержащий два остатка фенола, т. е. чисто ароматический простой эфир.
3) Образование сложных эфиров. Подобно спиртам фенолы могут давать соединения типа сложных эфиров. Практически для получения сложных эфиров фенолов обычно на феноляты действуют галогенангидридами кислот, например:
C6H5ONa + Cl–CО–СН3 → С6Н6–О–СО–СНз + NaCl.
Фенолы дают сложные эфиры как с органическими, так и с минеральными кислотами. Например, с мочой человека выделяется калиевая соль сернокислого эфира фенола.
4) Реакция окрашивания с хлорным железом. Все фенолы с хлорным железом образуют окрашенные соединения; одноатомные фенолы обычно дают окрашивание фиолетового или синего цвета. Эта реакция характерна не только для фенолов: соединения жирного ряда, т. е. гидроксил, стоящий у атома углерода с двойной связью, также дают реакцию окрашивания с FeCl3.
5) Замещение атомов водорода в бензольном ядре. Остаток бензола в фенолах влияет на гидроксильную группу, сообщая ей кислотные свойства. Однако и гидроксил, введенный в молекулу бензола, влияет на остаток бензола, увеличивая реакционную способность атомов водорода в бензольном ядре. В результате атомы водорода в ядре молекулы фенола замещаются гораздо легче, чем в ароматических углеводородах:
1. замещение галогенами. При действии на фенолы галогенов, даже бромной воды, три атома очень легко замещаются, и получаются тригалогенозамещенные фенолы.
Атомы брома замещают атомы водорода, находящиеся в орто и параположении по отношению к гидроксильной группе. Трибромфенол плохо растворим в воде и выпадает в осадок, в связи с чем реакция его образования может служить для обнаружения фенола;
2. замещение остатком азотной кислоты. Фенолы очень легко нитруются. Так, при действии даже очень разбавленной азотной кислоты получается смесь нитрофенола;
3. замещение остатком серной кислоты. Фенолы легко сульфируются; из фенола при этом получается смесь о и п фенол сульфокислот.
Преобладание того или иного изомера зависит от температуры: при 25 °С образуется преимущественно ортоизомер, при 100 °С — параизомер.
6) Окисление фенолов. Фенолы легко окисляются даже при действии кислорода воздуха. При этом они изменяют свой цвет, окрашиваясь в розовый, красно розовый или темно красный цвет. Примеси к фенолам ускоряют окисление, и поэтому неочи щенные фенолы обычно темнеют очень сильно и быстро.
Первой стадией при окислении фенолов является отщепление атома водорода от гидроксильной группы с образованием свобод ного феноксильного радикала с одновалентным кислородом. Эти радикалы далее вступают в различные сложные химические превращения, часто с образованием более крупных молекул.
При более энергичном окислении фенолов (например, хромо вой смесью) наряду с окислением фенольного гидроксила окисляется атом водорода, находящийся в параположении по отношению к гидроксильной группе; при этом в конечном итоге образуются бензохинон и продукты его дальнейших превращений. В условиях еще более энергичного окисления бензольное ядро фенолов разрушается.
7) Антисептические свойства. Фенолы убивают многие микроорганизмы, этим свойством пользуются в медицине, применяя фенолы и их производные как дезинфицирующие и антисептические средства. Фенол (карболовая кислота) был первым антисептическим средством, введенным в хирургию Листером в 1867 г. Антисептические свойства фенолов основаны на их способности свертывать белки.
Гомологи фенола — крезолы — оказывают более сильное бактерицидное действие, чем сам фенол.
Бактерицидное действие различных антисептических средств часто сравнивают с таковым фенола. Фенольный коэффициент — число, показывающее, во сколько раз антисептическое действие данного вещества больше (или меньше) действия фенола, принимаемого за единицу.
Путем введения в молекулы фенолов различных заместите лей — атомов галогена и другие — был получен ряд антисептических средств, более ценных, чем сам фенол.
Отдельные представители
Фенол, или карболовая кислота, Acidum carbolicum, C6H5OH — кристаллическое вещество с характерным запахом, розовеющее на воздухе вследствие окисления. С водой образует кристаллогидрат С6Н5ОН, плавящийся при 16 °С. В воде фенол растворяется в от ношении 1 : 15 (при 20 °С). Растворы фенола с FeCl3 дают фиолетовое окрашивание. Кристаллы фенола на воздухе поглощают атмосферную влагу и расплываются, образуя раствор воды в феноле.
Применение фенола в медицине в связи с его токсичностью ограничено, причем он применяется лишь как наружное средство. Большое количество фенола используется для синтеза красителей, пикриновой кислоты, салициловой кислоты и других лекарственных веществ, а также для производства искусственных смол — фенолоальдегидных смол, например бакелитов.
Простые эфиры фенола. Метиловый и этиловый эфиры фенола называются соответственно анизол и фенетол.
Оба вещества представляют собой жидкость.
Нитрофенолы. Существуют моно , ди и тринитрофенолы. Введение нитрогруппы в молекулу фенола сильно повышает его кислотные свойства: в отличие от фенолов нитрофенолы способны разлагать углекислые соли, вытесняя угольную кислоту. Это свойство нитрофенолов связано со способностью их находиться в двух таутомерных формах — бензоидной и хиноидной, или ациформе.
При образовании ациформы атом водорода из фенольного гидроксила переходит к атому кислорода в нитрогруппе, что сопровождается перераспределением сил химического сродства. Свободные нитрофенолы обычно имеют желтую окраску различной интенсивности и оттенков или бывают практически бесцветны ми. Это зависит от количественного соотношения двух таутомерных форм нитрофенолов: бесцветной бензоидной и ярко желтой ациформы. Это соотношение зависит не только от природы нитрофенола, но и от концентрации водородных и гидроксильных ионов.
В связи с изменением окраски нитрофенолов в зависимости от реакции среды, т. е. концентрации водородных ионов, некоторые нитрофенолы применяются как индикаторы.
Большое значение имеет тринитрофенол, обычно называемый пикриновой кислотой. Пикриновую кислоту можно получить нитрованием фенола смесью концентрированной азотной и серной кислот; существуют и другие экономически более выгодные методы.
Как и другие нитрофенолы, пикриновая кислота существует в двух таутомерных формах.
Она представляет собой кристаллическое вещество желтого цвета, горького вкуса. При нагревании легко взрывается. Пикриновая кислота в связи с наличием трех остатков азотной кислоты представляет собой довольно сильную кислоту, приближающуюся по степени диссоциации к минеральным кислотам.
Пикриновая кислота широко применяется как взрывчатое вещество в свободном состоянии и в виде солей калия и аммония, а также как красящее вещество. Она применяется при лечении ожогов.
При восстановлении в мягких условиях (например, при кипячении с глюкозой и содой) одна нитрогруппа пикриновой кислоты восстанавливается в аминогруппу, в результате чего пикриновая кислота превращается в пикраминовую кислоту. Пикраминовая кислота — вещество оранжевого цвета; как и пикриновая кислота, она существует в двух таутомериых формах.
Если пикриновая кислота попадает в организм человека (при случайных отравлениях или при недостаточной охране труда на производствах, где она употребляется), то происходит восстановление пикриновой кислоты в пикраминовую, которая окрашивает кожные покровы и ткани в оранжевый цвет: наступает искусственная желтуха.
При действии на пикриновую кислоту хлорной известью или хлором происходит окисление и расщепление молекулы пикриновой кислоты с одновременным хлорированием. В результате образуется так называемый хлорпикрин С13С–NО2 (рациональ ное название нитрохлороформ). Хлорпикрин применяется для борьбы с некоторыми видами насекомых. В первую мировую вой ну хлорпикрин применялся в качестве БОВ слезоточивого действия.
Аминофенолы. П аминофенол получается восстановлением п нитрофенола, в котором нитрогруппа NО2 при этом превра щается в аминогруппу NH2.
Большое значение имеет этиловый эфир п-аминофенола — п-фенетидин. При ацетилировании п-фенетидина получается общеизвестное жаропонижающее средство — фенацетин.
Легко окисляющийся (и поэтому применяющийся в фотографии) л-аминофенол очень ядовит, но его производное — фенацетин — этими свойствами не обладает, так как его фенольный гидроксил этерифицирован этильной группой, а аминогруппа ацетилирована.
Фенолоформальдегидные смолы. Взаимодействие фенола с формальдегидом с образованием смолообразных продуктов стало известно еще в XIX в. (Байер, 1872 г.). Механизм образования фенолоформальдегидных смол весьма сложен.
Схематически можно представить его следующим образом. При взаимодействии фенола и формальдегида образуется в качестве главного продукта фенолоспирт — о оксибензиловый спирт, или салигенин, а также в соответствии с правилами замещения в бензольном кольце его п-изомер. Образовавшиеся о и п изомеры конденсируются с выделением воды.
Эти димеры, в свою очередь, могут конденсироваться друг с другом, а также с молекулами формальдегида и фенола (в зависимости от условий реакции, в частности от количества исходных продуктов). В конечном итоге могут образоваться продукты, имеющие сложную сетчатую структуру, в которой оксифенильные остатки связаны метиленовыми мостиками.
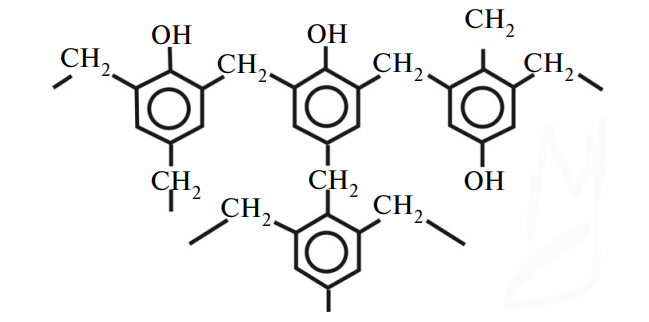
Фенолоформальдегидные смолы, применяемые в сочетании с другими материалам (наполнителями), носят общее название фенопластов. К ним относятся карболит (смола + древесная мука), текстолит (смола + хлопчатобумажиая ткань), гетинакс (смола + бумага), стеклотекстолит (смола + стеклянное волокно) и т. д. Изделия, изготовляемые из фенопластов, чрезвычайно разнообразны: бесшумные зубчатые передачи и другие части машин, строительные детали, кузова автомашин, бытовые предметы и др.
Фенолоформальдегидные смолы применяются как основа ио нитов. Ионитами или ионообменными смолами называются высокомолекулярные смолы (фенолоформальдегидные, полистирольные и др.), содержащие функциональные группы, способные легко обменивать свой катион или анион на соответствующий ион, содержащийся в растворе. В зависимости от обмениваемого иона иониты разделяются на катиониты и аниониты. В качестве ионообменивающих групп катионов обычно используются группы –S03H, –СООН; в анионитах — группы четвертичных оснований типа [Ar–NR3]OH и др.
Применение ионитов исключительно разнообразно. При про пускании воды, содержащей соли, последовательно через катиониты, а затем аниониты вначале происходит замена всех катионов солей на Н+, а затем всех анионов солей на ОН–, т. е. обессоливание воды.
Иониты дают возможность в научной работе и промышленности выделять из сложных смесей различные органические вещества, например витамины группы В, С. Для выделения алкалоидов, стрептомицина и других антибиотиков в заводских условиях также применяют иониты.
Катиониты, отдавая свои ионы водорода, заменяют катализа торы — кислоты, действуя более мягко и не требуя нейтрализации по окончании процесса.
Иониты применяются и как лекарственные препараты (на пример, при повышенной кислотности желудочного сока).
Широкое применение имеют также смолы, получающиеся при поликонденсации фенола с другими альдегидами вместо формальдегида.
Крезолы (С6Н4(СН3)(ОН)) вместе с фенолом содержатся во фракции среднего, или карболового, масла, получаемого при сухой перегонке каменного угля. Крезолы существуют в виде трех изомеров.
Обычно изомеры крезолов не разделяют, а применяют в виде смеси, которую часто называют трикрезолом.
Тимол, или параметилизопропилфенол, является фенолом, производным цимола. Тимол встречается в эфирных маслах некоторых растений; особенно много его (вместе с цимолом) в тимиановом масле.
Тимол представляет собой кристаллическое вещество с приятным запахом. Применяется в медицине, в стоматологии.
| 


