Нитрилы карбоновых кислот
Общая формула нитрилов R-C≡N или CnH2n+1CN.
Методы получения нитрилов.
-
- Дегидратация амидов карбоновых кислот с помощью водоотнимающих агентов.
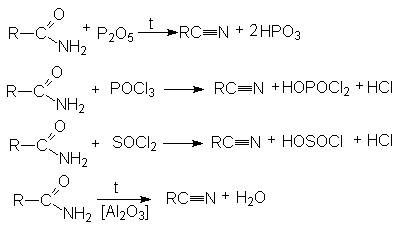
На практике в последнем случае пропускают над катализатором смесь карбоновой кислоты с аммиаком. В этом процессе совмещается образование амида и его дегидратация.
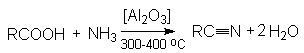
-
- Нуклеофильное замещение галогена в галогеналканах на циaнид-анион.
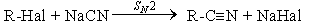
-
- Дегидратация альдоксимов.
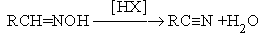
Механизм реакции:
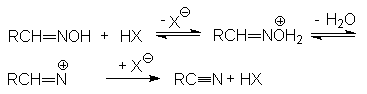
Химические свойства нитрилов.
Циано-группа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте
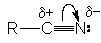
Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
-
- Реакции нуклеофильного присоединения.
Нитрилы легко реагируют с сильными анионными нуклеофильными реагентами (карбанионами, амидами металлов, щелочами, алкоголятами, тиоалкоголятами)
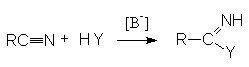
Примером может служить щелочной гидролиз нитрилов:
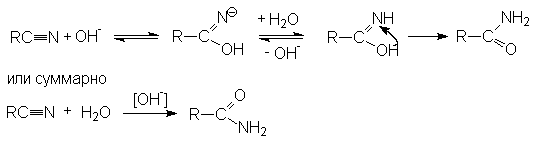
Дальнейший гидролиз амида приводит к образованию солей карбоновых кислот.
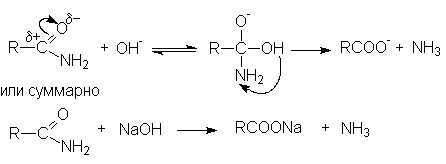
Таким образом суммарное уравнение щелочного гидролиза нитрилов можно представить как
R-C≡N + H2O + NaOH → RCOONa + NH3
Реакции нитрилов со слабыми нуклеофилами (водой, спиртами) протекает крайне медленно. Для эффективного проведения этих реакций используют кислотный катализ. Активация молекулы нитрила в этом случае осуществляется за счет образования водородной связи между кислотой – катализатором и атомом азота и, как следствие, увеличение положительного заряда на нитрильном углеродном атоме.
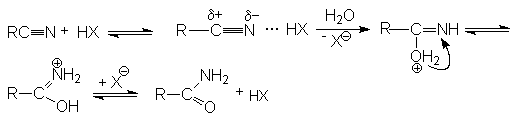
На последующей стадии гидролиза кислота НХ выступает одновременно как ускоритель реакции и реагент.
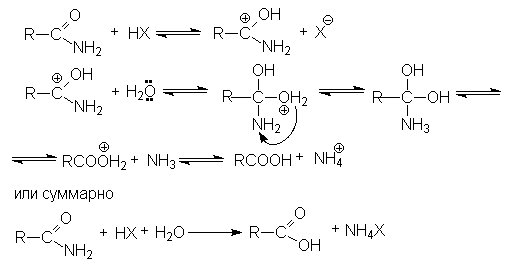
Таким образом, полный кислотный гидролиз нитрилов описывается уравнением:
R-C≡N + 2H2O + HX → RCOOH + NH4X
Если в качестве реагента использовать водно-спиртовые среды, то можно осуществлять синтез сложных эфиров
R-C≡N + R'OH + H2O + HX → RCOOR' + NH4X
Реакции гидрирования нитрилов можно подразделить на две группы:
а) каталитическое гидрирование
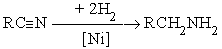
В качестве катализаторов этих реакций используют металлические Pt, Pd, Ni.
б) реагентное гидрирование
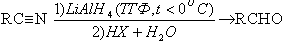
В качестве реагентов этих реакциях используют LiAlH4, NaBH4.
Механизм реакции:
RC≡N + LiAlH4 → RCH=N-Li + AlH3
RCH=N-Li + HX → RCH=NH + LiX
Механизм второй стадии:
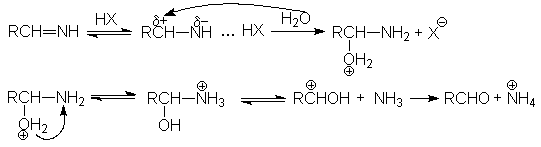
-
- Взаимодействие с металлоорганическими соединениями.
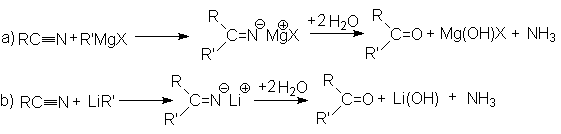
Эта реакция является примером присоединения атома углерода к гетероатому (азоту).
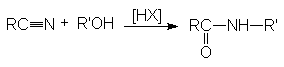
Реакция протекает по карбкатионному механизму:
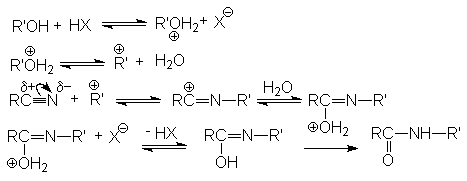
В реакцию вступают только спирты, дающие достаточно стабильные карбкатионы (вторичные, третичные, бензильные и т.п.). Первичные спирты не реагируют. Карбкатионы не обязательно следует генерировать из спирта, его можно получать протонированием алкенов.
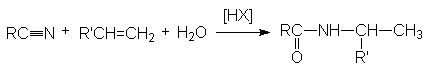
| 


