Физические свойства алканолов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматический запах.
Отличительная черта алканолов - более высокая температура кипения, чем для соответствующих хлор-, бром- и иодалканов, несмотря на то, что молекулярные массы галогеналканов выше.
Это явление обусловлено сильными межмолекулярными взаимодействиями в спиртах за счет образования водородных связей.
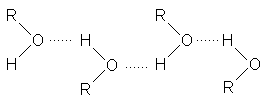
Алканолы содержат две полярные связи Сd +-Оd- и Od+ - Hd- . Диполи этих связей направлены навстречу друг другу. Однако результирующий дипольный момент направлен от группы R.
Потенциал ионизации алканолов ниже, чем у воды, что обусловлено +I - эффектом алкильной группы.
Спектры поглощения.
Алканолы в электронных спектрах поглощения являются “прозрачными”. Слабое поглощение наблюдается только в дальней УФ - области (170-180нм), что связано с переходом n >>>σ* неподеленной пары электронов кислорода.
В ИК - спектрах характерные колебания связи ОН в разбавленных растворах углеводородов или галогенуглеводородов наблюдаются в области 3580 - 3650 см-1. В концентрированных растворах образуются водородные связи
О ¾ H •••• О, поэтому валентные колебания связи О - Н смещается в область 3200-3500 см-1.
В спектрах ПМР сигнал группы ОН наблюдается в широком интервале d =2 - 4,5 м.д. в зависимости от типа растворителя и концентрации вещества. Характерные сигналы протонов Н - С - О при d = 3,5 - 3,8 м.д.
Химические свойства
Кислотность
Спирты являются слабыми -ОН - кислотами, которые проявляются во взаимодействии с сильными основаниями.
ROH + ОН- >>> RO- + H2O
Это равновесие существенно смещено в левую сторону, т.к. RO- дестабилизирован из-за положительного индуктивного эффекта алкильной группы. Обычно для получения алкоголятов применяют реакцию активного металла с безводным спиртом.
2ROH + 2Na >>> 2RONa + H2
6ROH + 2Al >>> 2Al(OR)3 + 3H2
Высокая основность алкоголятов используется для успешного осуществления реакций дегидрогалогенирования и генерирования карбанионов и других анионов, играющих ключевую роль в реакциях конденсации органических соединений
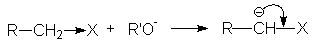
В тоже время алкоголят-анионы являются достаточно сильными нуклеофилами, что позволяет использовать их в качестве реагентов в некоторых важных реакциях нуклеофильного замещения, например, в синтезе простых и сложных эфиров.
RHal + R¢ ONa → R¢ OR + NaHal
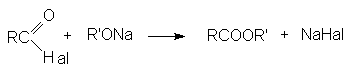
Основность
Неподеленная электронная пара на кислородном атоме гидроксильной группы обуславливает возможность взаимодействия его с электрофильными реагентами с образованием донорно-акцепторной связи, при этом кислородный атом приобретает положительный заряд и образуются оксониевые соединения:
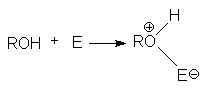
где E - кислота Льюиса, например BF3, AlCl3, PCl3, SOCl2, TiCl4, SnCl4, H+, NO2 и др.
Алканолы являются слабыми основаниями
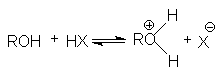
В присутствии сильных концентрированных кислот равновесие в достаточной степени смещено в правую сторону.
Последняя реакция обусловливает легкое отщепление уходящей группы, H2O, и это создает благоприятные условия для реакции нуклеофильного замещения, например, при синтезе простых эфиров.
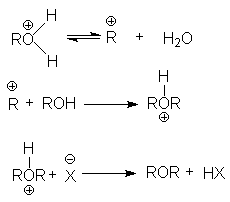

при замещении гидроксильной группы на галоген или другой кислотный остаток
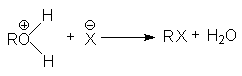
или суммарно:
ROH + HX → RX + H2O
при алкилировании аренов спиртами
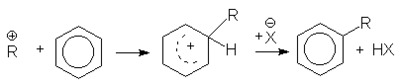
или суммарно:
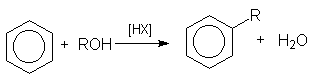
в реакции дегидратации спиртов
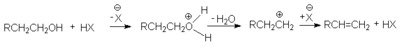
в различных перегруппировках, связанных с перегруппировками карбкатиона
а) миграция алкильных групп
б) миграция водорода
в) аллильная перегруппировка
г) ретропинаколиновая перегруппировка
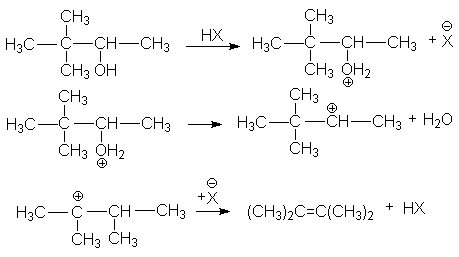
или суммарно:
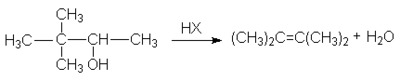
| 


