Физические свойства и строение
Галогенпроизводные углеводородов являются бесцветными газами или жидкостями со своеобразным сладковатым запахом. В воде нерастворимы и в большинстве случаев тяжелее ее. Некоторые полигалогенпроизводные образуют бесцветные кристаллы, полииодсоединения имеют желтую окраску.
Температура кипения возрастает при увеличении атомной массы галогена и числа атомов галогена и углерода. Исключением являются полифторалканы, температура кипения которых уменьшается при увеличении числа атомов фтора в молекуле полифторалкана. При переходе от фторпроизводных к подпроизводным увеличивается их поляризуемость, что соответствует ряду поляризуемости атомов:
J > Br > Cl > F
Энергия связи С-Hal меняется в ряду
D(C – F) > D(C – Cl) > D(C – Br) > D(C – J)
Моногалогенпроизводные имеют значительные дипольные моменты, что свидетельствует о полярности связи С-Hal. Это связано с более высокой электроотрицательностью атомов галогенов по сравнению с углеродными атомами:

Неподеленные пары электронов на атомах галогенов придают молекуле галогенуглеводородов слабые электронодонорные свойства, которые увеличиваются в ряду
RJ > RBr > RCl > RF
Химические свойства
Химическое поведение галогенуглеводородов определяется такими факторами как энергия связи С–Hal, полярность этой связи и ее поляризуемость. Так, относительная слабость связей С–Cl, C–Br и СJ обусловливает их предпочтительное гомолитическое расщепление по сравнению со связями С–С и С–Н. В то же время полярность связей С–Hal и их более высокая поляризуемость по сравнению со связями С–С и С–Н является предпосылкой для их гетеролитического расщепления. Приводимые ниже реакции являются иллюстрацией этих положений.
1. Замещение галогена на водород.
Восстановление галогенпроизводных до углеводородов осуществляется водородом в присутствии обычных катализаторов гидрирования (Ni, Pt, Pd):
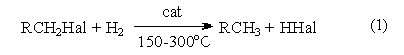
Реакция имеет гомолитический характер, связанный с предварительной сорбцией реагентов на поверхности катализатора, причем водород претерпевает диссоциативную адсорбцию с вовлечением адсорбированных атомов водорода в реакцию восстановления
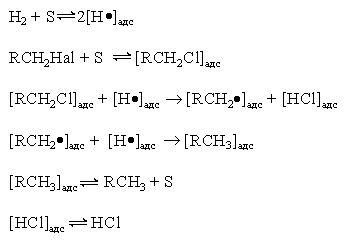
где S – поверхность катализатора.
Реакция (1) имеет важное практическое значение как метод переработки галогенорганических отходов в промышленном органическом синтезе. В отличие от другого метода обезвреживания галогенорганических отходов, сжигания, этот метод является ресурсосберегающим и экологически безопасным, так как при его реализации регенерируется углеводородная составляющая исходного сырья и исключается образование высокотоксичных полихлордибензодиоксинов и полихлордибензофуранов.
Другой метод замещения галогена на водород – взаимодействие галогенпроизводных углеводородов с иодоводородной кислотой при нагревании
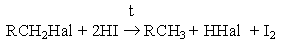
Метод имеет препаративное значение.
2. Взаимодействие с металлами.
а) реакция димеризации (синтез Вюрца)
2RHal + Na → R–R + 2NaHal
Механизм этой реакции может быть представлен следующей последовательностью стадий:
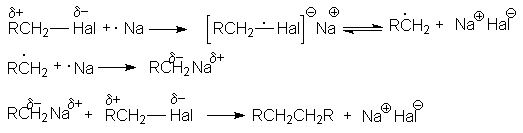
Такой характер взаимодействия является выражением природы реагентов. Натрий как очень активный металл легко отдает свой электрон молекуле галогенуглеводорода, которая выступает в роли слабого электрофила. Электрофильные свойства молекулы R–Hal вытекают из полярности связи С–Hal, обусловливающей дефицит электронов на атоме углерода. Образующийся интермедиат распадается на алкильный радикал и натриевую соль галогена, причем прочная ионная связь в последней обусловливает легкость этого распада. Аналогично можно объяснить энергетическую выгодность последующих реакций механизма.
Реакция имеет препаративное значение.
б) Взаимодействие с магнием (реакция Гриньяра).
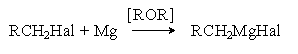
Механизм этой реакции в части ее инициирования подобен механизму реакции Вюрца
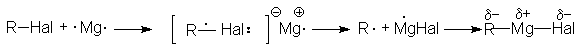
Реактивы Гриньяра имеют важнейшее значение в препаративной органической химии, поскольку открывают возможности получения широкого разнообразия органических соединений на основе взаимодействия этих реактивов с различными реагентами.
3. Реакции нуклеофильного замещения
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O → ROH + HHal
RHal + NaOH → ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa → ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa → RCOOR1 + NaHal
г) аммонолиз
RHal + 2NH3 → RNH2 + NH4Hal
д) синтез нитросоединений и нитритов

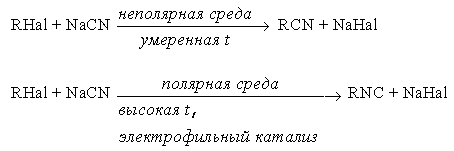
е) синтез нитрилов и изонитрилов
ж) синтез тиолов и сульфидов
R–Hal + NaSH → RSH + NaHal
R–Hal + R1SNa → RSR1 + NaHal
2R–Hal + Na2S → RSR + 2NaHal
з) синтез фосфорорганических соединений
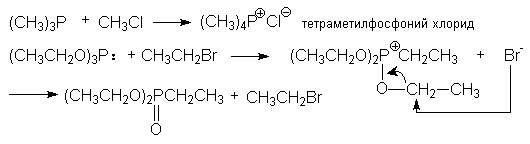
(CH3)2PH + CH3CH2Br + NaOH → (CH3)2PCH2CH3 + NaBr + H2O
диметилэтилфосфин
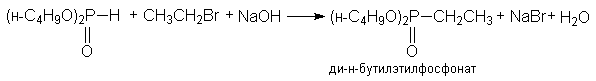
и) синтез углеводородов на основе Mg-органических соединений
R–MgHal + R’Hal → R–R’ + MgHal2
к) замещение галогена на галоген
RX + NaY → RY + NaY
(см. подробно методы получения галогеналканов)
Из приведенных реакций можно видеть, что реакции нуклеофильного замещения могут служить методом образования связей С–С, С–О, С–S, C–N, C–P и C–Hal.
| 


