Физические свойства и строение простых эфиров
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира) со своеобразным запахом и низкими температурами кипения, что свидетельствует о слабом межмолекулярном взаимодействии. Это является показателем низкой полярности диалкиловых эфиров и отсутствия (в отличие от спиртов) предпосылок для образования водородных связей. В отличие от спиртов эфиры обладают более сильными электронодонорными свойствами, о чем свидетельствует значение потенциалов ионизации. Увеличение электронодонорных свойств обьясняется положительным индуктивным эффектом алкильных групп. Валентный угол приближается к тетраэдрическому и равен 109–1120.
Химические свойства простых эфиров
-
Основность
Основность простых эфиров проявляется в их взаимодействии с кислотами Бренстеда и Льюиса. С Бренстедовскими кислотами умеренной силы взаимодействие осуществляется посредством водородной связи.
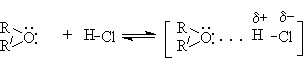
В случае сильных Бренстедовских кислот происходит протонирование эфиров и образование оксониевых кислот.
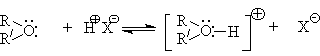
Простые эфиры – слабые основания и начинают протонироваться в ощутимых количествах в растворе 30 - 40%-ной серной кислоты.
С кислотами Льюиса диалкиловые эфиры образуют стабильные продукты присоединения – эфираты.
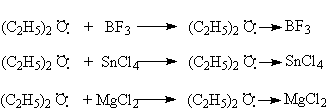
В этих соединениях образуется донорно–акцепторная связь за счет неподеленной пары атома кислорода.
Способность простых эфиров сольватировать катионы различных металлов имеет исключительное значение для получения металоорганических соединений в растворах диалкиловых эфиров или тетрагидрофурана.
-
Реакции при α - углеродном атоме диалкиловых эфиров.
Простые эфиры могут вступать в реакции свободнорадикального хлорирования и автоокисления, причем обьектом этих реакций является α - углеродный атом эфиров.
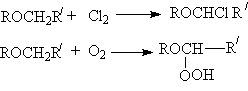
Основанием для такого направления является стабильность α - алкилалкоксирадикалов,
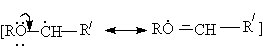
обуслoвливающая энергетическую выгодность реакции инициирования (в случае автоокисления) и развития цепей (в случае автоокисления и хлорирования)
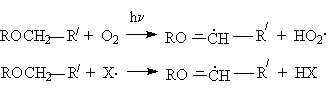
где Х. – радикал цепи при хлорировании (Cl.) и автоокислении
Образующиеся в результате автоокисления гидропероксиды являются взрывчатыми веществами. Они могут образовываться в эфирах при хранении в условиях доступа воздуха и в прозрачных бутылках. Поэтому эфиры после длительного хранения перед употреблением подлежат обработке с целью разрушения гидропероксидов.
-
Реакции расщепления С - О – связи
Эфиры расщепляются под действием сильных кислот, например, иодоводородной, бромоводородной, суперкислот:
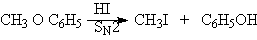
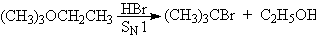
При действии суперкислот на эфиры при низких температуах генерируются карбкатионы, которые могут претерпевать различные перегруппировки и распад до алкенов.
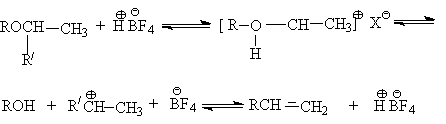
При этом легче расщепляются простые эфиры, которые содержат разветвленные группы, так как в результате протонирования образуются более устойчивые карбкатионы.
| 


