Амины.
Физические, химические свойства и строение.
Алифатические амины – бесцветные вещества с неприятным запахом. Низшие амины – жидкости, хорошо растворимые в воде. По растворимости они превосходят спирты с близкой молекулярной массой. Это объясняется образованием между амином и водой водородных связей типа 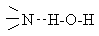 , прочность которых сравнительно велика в силу высокой основности атома азота. Температуры кипения и плавления у третичных аминов ниже, чем у первичных и вторичных с примерно одинаковой молекулярной массой, что связано с ассоциацией последних за счет образования межмолекулярных водородных связей. , прочность которых сравнительно велика в силу высокой основности атома азота. Температуры кипения и плавления у третичных аминов ниже, чем у первичных и вторичных с примерно одинаковой молекулярной массой, что связано с ассоциацией последних за счет образования межмолекулярных водородных связей.
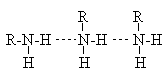
Однако эти межмолекулярные водородные связи слабее, чем у спиртов, по причине меньшей полярности связи N-Н по сравнению со связью О-Н. Вследствие этого амины имеют более низкие температуры кипения, чем спирты с близкой молекулярной массой.
Амины имеют пирамидальное строение. Величины углов R-N-R близки к тетраэдрическому – 106-1080. Считается, что атом азота находится в состоянии sp3-гибридизации, а четвертым лигандом является неподелённая пара электронов (“фантом”-лиганд).
Третичные амины с разными углеводородными радикалами должны быть хиральными, так как их молекулы не имеют плоскости симметрии. Однако за счет быстрой пирамидальной инверсии, которая представляет собой акт рацемизации, их невозможно выделить или зафиксировать в оптически активной форме.
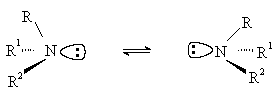
Четвертичные аммониевые соли в случае разных заместителей существуют в виде пары устойчивых энантиомеров.
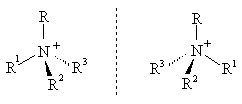
Спектральные характеристики.
В электронных спектрах аминов наблюдается поглощение в дальней УФ-области при 195-215 нм, что соответствует возбуждению неподеленной пары электронов азота (переход n→ σ* ).
В ИК-спектрах первичных и вторичных аминов наблюдаются полосы поглощения, связанные с валентными колебаниями связей N-H. Первичные амины характеризуются двумя полосами поглощения при ~3400 и ~3500 см-1, вторичные амины – одной полосой при ~3500 см-1.
В спектрах ПМР химический сдвиг протонов связи N-H находится в области 1-5 м.д. и значительно меняется в зависимости от концентрации, температуры и растворителя.
Химические свойства
Химическое поведение аминов определяется в основном наличием свободной пары электронов у атома азота, которая обусловливает их основные и нуклеофильные свойства. Реакции с участием связей N-H и N-C под действием оснований и нуклеофильных реагентов для аминов менее характерны.
Основные свойства
Алифатические амины являются одними из самых сильных незаряженных оснований (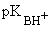 ~ 10 - 11). Их водные растворы имеют щелочную реакцию. ~ 10 - 11). Их водные растворы имеют щелочную реакцию.
R3N + H2O = R3NH+ + OH -
С неорганическими кислотами амины образуют соли, которые в большинстве случаев хорошо растворимы в воде.
R3N + HX = R3N+X -
Основность аминов зависит от их строения и природы растворителя. Сравнение основности в водных растворах показывает, что алкиламины являются более сильными основаниями, чем аммиак. Вторичные амины превосходят по основности первичные. Такой ряд основности согласуется с электронодонорным влиянием алкильных групп (+I-эффект), которое способствует делокализации положительного заряда в сопряженной кислоте (ионе аммония) и тем самым стабилизирует её в большей степени, чем свободный амин. Однако это не объясняет уменьшения основности при переходе от вторичных аминов к третичным.
|
|
NH3
|
C2H5NH2
|
(C2H5)2NH
|
(C2H5)3N
|
|
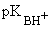
|
9,25
|
10,80
|
11,09
|
10,85
|
Вероятно, такое снижение основности связано с сольватацией. Сольватация молекулами воды триалкиламмониевого катиона затруднена присутствием трех гидрофобных алкильных групп и снижением возможности образования водородных связей.

Это предположение подтверждается тем, что в газовой фазе и в малополярных растворителях третичные амины превосходят по основности вторичные.
| 


