Физические свойства
Насыщенные альдегиды и кетоны являются бесцветными жидкостями со своеобразным запахом (формальдегид – газ с острым запахом). Температуры кипения ниже, чем у соответствующих алканолов.
Карбонильная группа – сильно полярная группа. В то же время она обладает значительной поляризуемостью. Это можно проиллюстрировать данными молекулярной рефракции связей. Так, для связей С–О R=1,5, а для связи С=О R=3,3 ... 3,5. Это означает, что на атомах карбонильной группы не только имеются значительные эффективные заряды, но они еще увеличиваются под действием внешних факторов (атакующих реагентов).
Положительный заряд на карбонильном углероде обусловливает его восприимчивость к атаке нуклеофильными реагентами. В то же время карбонильный кислород обладает основностью и может благодаря этому протонироваться под действием Бранстедовских кислот.
В УФ-спектрах карбонильных соединений имеются два максимума поглощения: интенсивный в диапазоне 150-200 нм (p – π *) и малоинтенсивный в диапазоне 270-300 нм (n – π*).
Характерны четкие максимумы в ИК-спектрах карбонильных соединений в области 1755 – 1695 см-1, которые связаны с валентными колебаниями группы С=О, причем альдегиды поглощают при более коротких волнах, чем кетоны.
ИК-спектры, а также спектры комбинационного рассеяния являются надежными методами для обнаружения карбонильной группы.
В ПМР-спектрах альдегидный протон имеет характерный сигнал = 8 ... 10,5 м.д., который обычно не перекрывается с сигналами других протонов.
Химические свойства альдегидов и кетонов
Химическое поведение альдегидов и кетонов определяется четырьмя факторами. Во-первых, положительный заряд карбонильного углерода обусловливает его восприимчивость к нуклеофильной атаке. При этом основность карбонильного кислородного атома создает возможность дополнительного увеличения положительного заряда на карбонильном углероде за счет протонирования первого кислотами
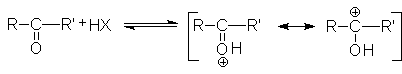
Благодаря этому карбонильный углерод может успешно атаковаться даже слабыми нуклеофилами. Подобная активация молекул карбонильных соединений реализуется в кислотном катализе реакций нуклеофильного присоединения по карбонильной группе.
Во-вторых, слабость π -связи в карбонильной группе обусловливает стехиометрический результат нуклеофильных реакций этих соединений: уходящей группой при нуклеофильной атаке является карбонильный атом кислорода, который сохраняет свою σ -связь с карбонильным углеродным атомом.
В-третьих, электроноакцепторный характер карбонильной группы за счет –I и –M–эффектов обусловливает кислотность водородных атомов при соседних с ней углеродных атомов, что проявляется в способности последних отщеплять протон под действием сильных оснований
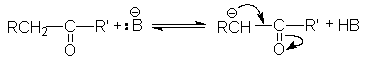
Можно видеть, что обоснованием кислотности водородных атомов при σ -углеродном атоме является стабилизация образующегося карбаниона за счет –I и –М–эффектов карбонильной группы.
Подвижность атомов водорода при α –углеродном атоме является предпосылкой для замещения этих атомов другими заместителями или группами, что находит свое выражение в реакциях α –галогенирования и конденсации.
В-четвертых, промежуточная степень окисления карбонильных групп (+1 в альдегидах и +2 в кетонах) обусловливает их способность к реакциям окисления и восстановления.
| 


