Физические свойства и строение алициклических соединений.
Физические свойства циклоалканов аналогичны свойствам алканов. Это бесцветные нерастворимые в воде вещества. Циклопропан и циклобутан – газы, циклоалканы С5-С11 – жидкости, начиная с С12 – твердые вещества. Температуры кипения и плавления, а также плотности у циклоалканов несколько выше, чем у соответствующих алканов, что связано с большей упорядоченностью циклических структур.
Циклоалканы обладают разной термодинамической стабильностью, которая зависит от размера цикла. Это связано с существованием у циклических молекул напряжения. Напряжение возникает в результате отклонения параметров молекулы от стандартных величин. В циклических структурахсуществует три основных вида напряжения.
-
- Угловое напряжение (напряжение Байера) обусловлено отклонением валентных углов в цикле от стандартных значений.
- Торсионное напряжение (напряжение Питцера) – напряжение, вызванное заслоненным положением химических связей.
- Напряжение Ван-дер-Ваальса обусловленовзаимодействиями между валентно не связанными атомами при их сближении на расстояние меньшее суммы ван-дер-ваальсовых радиусов. В циклах этот тип напряжения проявляется во взаимодействии между атомами, расположенными на противоположных сторонах. Такие взаимодействия называют трансаннулярными, а возникающее в результате напряжение - трансаннулярным (или напряжением Прелога).
Молекулы стремятся принять конформацию, свободную от всех видов напряжения. Циклические молекулы, как правило, не могут полностью освободиться от напряжения, так как для них снятие одного вида напряжения приводит к увеличению другого. Поэтому они стремятся принять конформацию, в которой сумма всех видов напряжения минимальна.
Напряжение молекулы количественно выражается её избыточной энергией по сравнению со стандартным соединением, в котором все структурные параметры (длины связей, валентные углы, расстояния между валентно не связанными атомами) не отклоняются от стандартных значений и все связи находятся в заторможенных конформациях. Эта избыточная энергия называется энергией напряжения. Энергия напряжения определяется как разность энтальпий образования исследуемого вещества и стандартного вещества. Для циклоалканов стандартом служит линейный алкан с длинной цепью или циклогексан. И тот, и другой практически свободны от всех видов напряжения. Для сравнения термодинамической устойчивости циклоалканов используют энергию напряжения в расчете на одну группу СН2. Наибольшее напряжение существует в малых и средних циклах. Обычные циклы и макроциклы практически свободны от напряжения.
Энергии напряжения циклоалканов относительно циклогексана в расчете на одну группу СН2.
|
Циклоалкан
|
Энергия напряжения, кДж/моль
|
Циклоалкан
|
Энергия напряжения, кДж/моль
|
|
Циклопропан
|
37,7
|
Циклооктан
|
5,1
|
|
Циклобутан
|
26,4
|
Циклононан
|
5,9
|
|
Циклопентан
|
5,0
|
Циклодекан
|
5,0
|
|
Циклогексан
|
0
|
Циклоундекан
|
4,2
|
|
Циклогептан
|
3,7
|
Циклододекан
|
1,8
|
Малые циклы
Циклопропан
Молекулы циклопропана представляет собой правильный треугольник. Связи С-Н расположены в плоскости, перпендикулярной плоскости цикла.
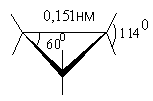
Это означает, что в молекуле циклопропана существует значительное угловое напряжение (валентные углы в цикле 600 вместо 1090 для sp3-гибридизации) и торсионное напряжение (все связи неизбежно находятся в заслоненном положении). Как результат этого, циклопропан имеет наибольшую среди циклоалканов энергию напряжения в расчете на одну группу СН2.
Связи С-С и С-Н в циклопропане отличаются от связей в алканах. Гибридные орбитали атомов углерода в циклопропане неэквивалентны. Орбитали, за счет которых образуются связи С-Н, имеют больший s-характер по сравнению с sp3 –гибридными орбиталями. Орбитали, образующие С-С связи, имеют меньший s-характер и, следовательно, близки по характеру к р-орбиталям. В силу геометрии молекулы при образовании С-С связей не достигается максимальное перекрывание атомных орбиталей. Орбитали перекрываются не на линии, связывающей центры атомов, а в стороне от кольца. Такие связи называют τ -связями (“банановые” связи). По своему характеру они занимают промежуточное положение между σ - и π -связями. Доказательством частичного π -характера С-С связей в циклопропане является сравнительно низкая энергия ионизации (для пропана 11,5 эВ, циклопропана – 10,5 эВ, пропена – 9,7.эВ), а также способность циклопропанового кольца к сопряжению с π -связями, что проявляется в спектральных характеристиках винилциклопропанов и их химических свойствах.
Циклобутан
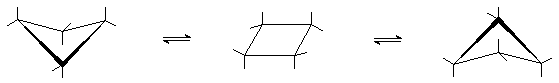
|
сложенная
|
плоская
|
сложенная
|
В случае плоского строения молекула циклобутана должна иметь угловое напряжение (валентные углы в цикле 900 вместо 1090) и торсионное напряжение (все связи находятся в заслоненном положении). В действительности циклобутан имеет неплоское строение. Он существует преимущественно в сложенной конформации с углом между плоскостями ~ 1450. Переход в сложенную конформацию уменьшает торсионное напряжение, так как связи переходят в частично скошенное положение. Однако при этом увеличивается угловое напряжение за счет уменьшения углов. Разница в энергиях между плоской и сложенной конформациями невелика
Искажение валентных углов приводит к тому, что связи в циклобутане изогнуты, но в значительно меньшей степени, чем в циклопропане. Общая напряженность молекулы циклобутана достаточно велика, но она меньше, чем у циклопропана.
Обычные циклы
Циклопентан
Плоский циклопентан практически лишен углового напряжения (валентные углы в цикле 1080 вместо 1090), но имеет значительное торсионное напряжение (заслоненное положение связей). Уменьшение энергии реальной молекулы циклопентана происходит за счет вывода из плоскости одного (конформация “конверт”) или двух соседних (конформация “твист”) атомов углерода.

При этом уменьшается торсионное напряжение, так как несколько связей переходят из заслоненного в скошенное положение. Одновременно происходит некоторое искажение валентных углов. Таким образом, молекула циклопентана имеет небольшое угловое и торсионное напряжения. Выигрыш в энергии при переходе из плоской конформации в конформации “конверт” или “твист” составляет 22 кДж/моль. Неплоские конформации циклопентана близки по энергии и быстро переходят друг в друга. При этом поочередно отгибаются все пять углов цикла, который, таким образом, находится в волнообразном движении (“псевдовращение”).
Циклогексан
Незамещенный циклогексан
В случае плоского строения циклогексан имел бы значительное угловое напряжение (валентные углы в цикле 1200 вместо 1090) и торсионное напряжение. Термодинамические измерения показывают, что циклогексан практически лишен всех видов напряжения.
Молекула циклогексана может существовать в виде нескольких неплоских конформаций, в которых сохраняются нормальные валентные углы:
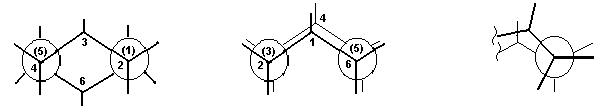 
Наиболее устойчивой из них является конформация “кресло”, которая лишена углового и торсионного напряжения. Рассмотрение проекций Ньюмена для любого из четырехуглеродных (бутаноподобных) фрагментов показывает, что в этой конформации нет заслоненных положений С-С и С-Н связей, а расположение С-С- связей такое же, как в скошенной конформации бутана.
Конформация “ванна”, несмотря на нормальные валентные углы, значительно менее устойчива. Это обусловлено торсионным напряжением, так как в заслоненном положении оказываются связи С-Н в положениях 2 и 3, 5 и 6 в основании ванны. Кроме того, возникает ван-дер-ваальсово напряжение между “бушпритными” атомами Н в вершинах “ванны” (положения 1 и 4), которые сближаются на расстояние, меньшее суммы их радиусов. В результате форма “ванны” на 29 кДж/моль превышает по энергии форму “кресла”.
“Твист” –конформация может быть получена из конформации “ванна” путем скручивания её вокруг центральной оси. При этом атомы С1 и С4 удаляются друг от друга, что приводит к устранению ван-дер-ваальсова напряжения, а атомы Н в основании ванны частично выводятся из заслоненного положения, что уменьшает торсионное напряжение. Т. о., конформация “твист” беднее энергией, чем конформация “ванны”, но превышает по энергии конформацию “кресла”.
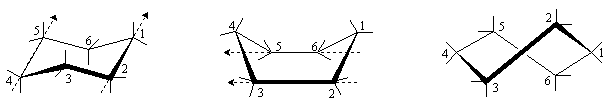
При обычных температурах циклогексан на 99,9% существует в конформации “кресла”. В этой конформации циклогексан имеет два типа связей С-Н: аксиальные (а) иэкваториальные (е). Аксиальные связи ориентированы параллельно оси симметрии цикла и направлены попеременно вверх и вниз. Экваториальные связи расположены под углом 1090 к оси симметрии цикла и направлены также попеременно вверх и вниз. Для незамещенного циклогексана возможны две энергетически равноценные конформации “кресла”, которые превращаются друг в друга путем вращения вокруг С-С связей. Такое превращение называют интерконверсией цикла. При интерконверсии все экваториальные связи переходят в аксиальные и наоборот.
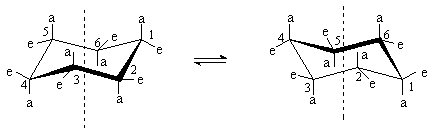
Взаимопревращение между двумя конформациями “кресла” происходит через ряд менее устойчивых форм. Механизм интерконверсии может быть представлен следующей схемой.

|
“кресло”
|
“полукресло”
|
“твист”
|
“ванна”
|
“твист”
|
“полукресло”
|
“кресло”
|
Конформация “кресло” переходит в “твист”-форму через стадию образования неустойчивой конформации “полукресло”, в которой в одной плоскости находятся четыре соседних атома углерода. Т. о., конформация “полукресло” является переходным состоянием между конформациями “кресло” и “твист”. Далее “твист”-конформация через конформацию “ванны” скручивается в другую сторону и превращается в альтернативную “твист”-конформацию и далее через конформацию “полукресло” превращается в другую конформацию “кресла”. Т. о., конформация “ванны” является переходным состоянием между двумя “твист”-формами.
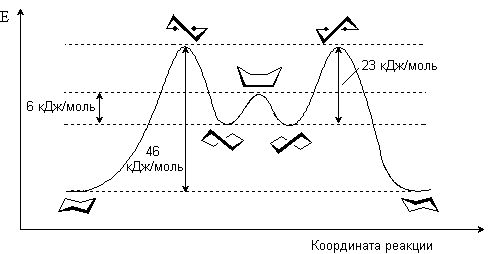
Энергетическая диаграмма процесса интерконверсии циклогексана
Как следует из энергетической диаграммы, из четырех энергетически неравноценных конформаций циклогексана конформерами являются конформации “кресло” и “твист”, которым соответствуют энергетические минимумы.
Монозамещенный циклогексан
Введение в циклогексан заместителя делает две конформации “кресла” энергетически неравноценными. Неравноценность аксиальных и экваториальных связей приводит к существованию двух конформеров – с аксиальным и экваториальным положением заместителя. Введение заместителя не влияет на скорость интерконверсии, поэтому при обычных условиях конформеры не могут быть выделены или зафиксированы с помощью спектральных методов. Однако введения заместителя влияет на положение конформационного равновесия, которое в подавляющем большинстве случаев смещено в сторону более устойчивого экваториального конформера.
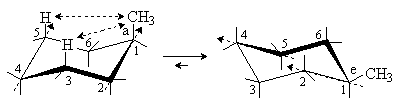
 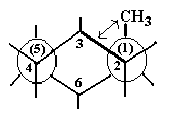
|
аксиальный конформер
|
экваториальный конформер
|
Причины разной устойчивости конформеров становятся ясными при рассмотрении проекций Ньюмена. В обоих бутаноподобных фрагментах, включающих заместитель, в аксиальном конформере группа СН3 находится в скошенном (гош-) положении относительно атомов углерода цикла С3 и С5. На рисунке представлена проекция вдоль связи С2→С1, из которой видно, что группа СН3 находится в гош-положении относительно атома С3. Аналогичное рассмотрение проекций Ньюмена экваториального конформера дает две заторможенные (анти-) конформации для группы СН3 и атомов углерода цикла С3 и С5. На рисунке представлена проекция вдоль связи С2→С1, из которой видно, что группа СН3 находится в заторможенном (анти-) положении относительно атома С3. Как известно, анти-конформация обладает меньшей энергией, чем гош-конформация, что делает аксиальный конформер энергетически менее выгодным. Кроме того, дополнительное напряжение возникает за счет взаимодействий через кольцо между аксиальным заместителем и атомами водорода в положениях 3 и 5 (1,3-диаксиальные взаимодействия), которых нет в экваториальном конформере.
Различие в энергиях аксиального и экваториального конформеров зависит от природы заместителя и возрастает с увеличением его размера. Количественно относительная устойчивость конформеров оценивается по разности их свободных энергий. Экспериментально определяют константу равновесия процесса интерконверсии
а = е
методом низкотемпературной ЯМР-спектроскопии. При температурах <-1000С процесс интерконверсии замедляется, и ЯМР-спектр представляет собой наложение спектров двух конформеров. Т.о., их относительное содержание в равновесной смеси может быть определено интегрированием соответствующих сигналов. Изменение энергии Гиббса рассчитывают по известной формуле
Δ GT0 = - RTlnK
Полученную величину называют свободной конформационной энергией заместителя.
Свободные энергии (- Δ G0) процесса интерконверсии для монозамещенных циклогексанов при 250С.
|
Заместитель
|
- D G0, кДж/моль
|
Заместитель
|
-D G0, кДж/моль
|
|
- CH3
|
7,5
|
- I
|
2
|
|
- C2H5
|
8
|
- OCH3
|
3
|
|
- CH(CH3)2
|
9
|
- C6H5
|
13
|
|
- C(CH3)3
|
23
|
- COOH
|
5
|
|
- F
|
1
|
- NH2
|
6
|
|
- Cl
|
2
|
- NO2
|
5
|
|
- Br
|
2
|
- OH
|
3
|
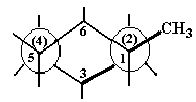
Дизамещенный циклогексан
При наличии в кольце двух заместителей у 1,2-, 1,3- и 1,4-дизамещенных производных существует цис-,транс-изомерия. Кроме того, при отсутствии плоскости симметрии возможна оптическая изомерия.
Наиболее устойчивой конформацией дизамещенных циклогексанов является конформация с большим числом экваториальных заместителей. Этот критерий может быть использован для оценки относительной устойчивости цис- и транс-изомеров.
Конформации цис- и транс-изомеров дизамещенных циклогексанов
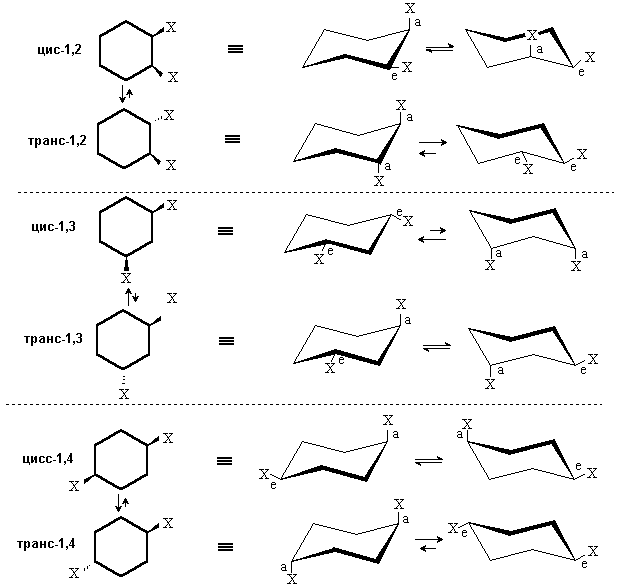
Из рассмотрения конформационного строения 1,2-цис- и 1,2-транс- дизамещенных циклогексанов следует, что более устойчивым является транс- изомер, поскольку для него возможна конформация, в которой оба заместителя занимают экваториальное положение. Аналогичный анализ конформационного строения показывает, что из 1,3-дизамещенных циклогексанов более устойчивым будет цис-, а из 1,4-дизамещенных - транс-изомер.
В случае полярных заместителей большое влияние на стабильность конформеров могут оказывать диполь-дипольные взаимодействия и Н-связи. В результате предпочтительным может оказаться аксиальное положение заместителей, как это имеет место в цис-1,3-циклогександиоле:
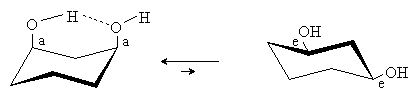
Средние циклы
Средние циклы обладают значительной энергией напряжения, которая достигает максимального значения у циклононана. Кроме углового и торсионного в них присутствует трансаннулярное напряжение, так как ряд связей С-Н направлен внутрь цикла и между атомами водорода возникают близкие контакты. Отталкивание между ними приводит к увеличению валентных углов и частично заслоненному положению заместителей.
Число возможных конформаций у средних циклов велико, что делает сложным их конформационный анализ. Однако для циклов С10 и выше с четным числом атомов задача упрощается, так как наиболее устойчивыми для них являются конформации, повторяющие фрагменты кристаллической решетки алмаза.
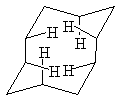
Конформация “алмаз” циклодекана
| 


