Алициклические углеводороды.
Название алициклических соединений возникло в связи с тем, что они содержат циклы, но по свойствам близки веществам жирного ряда — алифатическим соединениям. Алициклические со единения не содержат характерных для производных бензола ароматических связей.
Исключительно большая роль в изучении алициклических соединений принадлежит русским ученым. Основоположником химии алициклических соединений является В. В. Марковников.
Большая группа углеводородов алициклического ряда представляет собой циклы, состоящие из нескольких метиленовых групп; эти углеводороды называются полиметиленовыми. Вторая большая группа алициклических углеводородов — производные ментана, к которому близки терпены.
1. Полиметиленовые углеводороды, или циклоалканы
Полиметиленовые углеводороды состоят из нескольких мети леновых групп (СН2), имеют общую формулу СnН2n, т. е. являются изомерными олефинам. Полиметиленовые углеводороды называются также циклопарафинами, так как они, имея циклическое строение, в большинстве случаев обладают свойствами, близкими парафинам. Очень часто эти углеводороды, по предложению В. В. Марковникова, называют также нафтенами (что связано с выделением ряда их представителей из нефти).
Отдельные представители
Отдельные представители полиметиленовых углеводородов обычно называются по соответствующим насыщенным углеводородам жирного ряда с приставкой цикло. Так, простейший полиметиленовый углеводород С3Н6 называется циклопропан; углеводород С4Н8 — циклобутан, углеводород С5Н10 — циклопентан и т. д.
Способы получения
Такие циклопарафины, как циклопентан и циклогексан и их алкильные замещенные, в большом количестве содержатся в не которых видах нефти, например в кавказской. Кроме того, существует ряд способов их синтетического получения, например отщепление двух атомов галогена от галогенопроизводных углеводородов жирного ряда, содержащих атомы галогена у соответствующих различных атомов.
Физические и химические свойства
Циклопропан и циклобутан при обычной температуре — газы, циклопентан и циклооктан — жидкости, высшие представители — твердые вещества.
По химическим свойствам циклопарафины близки парафинам. Это довольно стойкие в химическом отношении вещества, вступающие с галогенами в реакции замещения. Исключение составляют первые два представителя — циклопропан и циклобутан. Эти вещества, особенно циклопропан, ведут себя подобно ненасыщенным соединениям жирного ряда — они способны присоединять галогены с разрывом кольца и образованием дигалогенопроизводных жирного ряда. Различия в поведении циклопропана и циклобутана и остальных представителей циклопарафинов объясняется теорией напряжения Байера. Согласно этой теории, чем больше отличаются валентные углы, образованные атомами кольца, от «нормальных», равных 109° 28', тем более напряженным будет кольцо. Угол между направлениями сил химического сродства в циклопропане равен 60° (как угол в равностороннем треугольнике), т. е. очень сильно отличается от обычного угла — 109° 28'. Валентные углы в циклобутане, если представить его молекулу лежащей в одной плоскости, равны 90° (как углы в квадрате). Большое отклонение от «нормальных» углов обусловливает напряжение циклов и легкость их разрыва. Валентные углы в циклогептане и циклогексане гораздо ближе к обычному углу — 109° 28', вследствие чего здесь напряжение гораздо меньше и кольца циклопентана и циклогексана являются наиболее прочными.
Валентные углы в циклопентане, если представить его цикл в виде правильного пятиугольника, лежащего в одной плоскости, равны 108°, т. е. очень мало отличаются от нормальных, но в циклогексане (при том же плоскостном его расположении) валентные углы равны 120°, т. е. больше отличаются от «нормальных». Отсюда нужно было бы ожидать меньшей прочности циклогекса на по сравнению с циклопентаном, чего на самом деле не наблюдается. Причиной является то, что кольцо циклогексана лежит не в одной плоскости, вследствие чего может быть ненапряженным. Наименее напряженными являются две конформации циклогексана: конформация «кресла» и конформация «лодки» наибольшей стабильностью из них обладает конформация «кресла».
Отдельные представители
Циклогексан (С6Н12) имеет весьма близкое отношение к ароматическому углеводороду бензолу, из которого может быть легко получен путем гидрирования:
С6Н6 + 6Н → С6Н12.
В связи с этим циклогексан часто называют гексагидробензолом, рассматривая его как гидроароматическое соединение.
Гидроароматическими называются соединения, получающиеся в результате полного или частичного гидрирования бензольного ядра в ароматических соединениях.
Циклогексан в значительном количестве содержится в кавказской нефти. Как показал Н. Д. Зелинский, циклогексан при 300 °С в присутствии палладиевой черни (тонко раздробленного палладия) дегидрируется, превращаясь в бензол:
С6Н12 → С6Н6 + 6Н.
Эта реакция лежит в основе процесса ароматизации нефти, имеющего большое народнохозяйственное значение.
При окислении азотной кислотой кольцо циклогексана разрывается, и образуется адипиновая кислота: НООС—(СН2)4–СООН.
2. Ментан, терпены
Ментан, или n метилизопропилциклогексан, можно рассматривать как полностью гидрированный цимол, или n метилизопропилбензол.
Ментан в природе не встречается, а получается синтетически гидрированием цимола.
Для облегчения обозначений многочисленных производных ментана нумеруют атомы углерода в его формуле, как показано.
Терпены — группа углеводородов, имеющих общую формулу С10Н16 и близких по своему строению ментану и цимолу. От ментана терпены отличаются меньшим содержанием водорода (т. е. обладают ненасыщенностью), а от цимола — большим содержанием водорода (т. е. являются гидрированными, хотя и не пол ностью, производными цимола).
Таким образом, терпены занимают промежуточное положе ние между цимолом — веществом ароматического ряда, и ментаном — полностью гидрированным производным цимола: С10Н14 — цимол, С10Н16 — терпены, С10Н20 — ментан.
Терпены встречаются в природе в соке и смоле хвойных деревьев, а также во многих эфирных маслах ряда растений. Эфирные масла получают из различных частей растений, причем лучшие эфирные масла получают из цветов. Для получения эфирных масел пользуются различными методами; чаще всего их отгоняют в водяным паром, реже — извлекают органическими растворителями; существуют и другие способы получения. В эфирных маслах наряду с терпенами содержатся самые различные вещества, относящиеся к спиртам, альдегидам, кетонам и другим группам органических соединений.
Общие свойства терпенов
Все терпены — жидкости. Являясь неполностью гидрированными производными цимола, они содержат в молекулах двойные связи (одну или две) и поэтому способны присоединять бром, хлористый водород и т. д. Важное свойство терпенов — их способность окисляться кислородом воздуха. Процесс окисления терпенов очень сложен и протекает по разному в сухом и влажном воздухе.
В сухом воздухе происходит образование перекисных соединений, которые далее отдают свой кислород, превращаясь в окисные соединения. Окисляющие свойства долго стоявшего озонированного скипидара, основанные на присутствии в нем перекисных соединений, использовались ранее при применении такого скипидара в качестве противоядия, например при отравлении фосфором.
Терпены в зависимости от строения делятся на несколько групп, из которых наиболее большое значение имеют моноцик лические и бициклические терпены.
Моноциклические терпены
Моноциклические терпены содержат в молекуле один цикл. Они присоединяют четыре атома брома, т. е. имеют две двойные связи. Представителем моноциклических терпенов может служить лимонен.
Лимонен имеет одну двойную связь в ядре — между первым и вторым атомами углерода — вторую — в боковой трехуглеродной цепи. Лимонен содержится во многих эфирных маслах, в частности в лимонном масле. Приятный запах лимонов зависит от лимонена, находящегося в эфирном масле лимонов; отсюда и возникло название «лимонен».
Лимонен содержится также в эфирных маслах некоторых хвойных растений, например в эфирном масле сосновых игл. При перегонке с водяным паром хвои сосны и пихты получают «лесную воду» — жидкость с приятным ароматическим запахом.
Бициклические терпены
Бициклические терпены содержат в молекуле два цикла. Их молекулы присоединяют по два атома брома, следовательно, бициклические терпены имеют одну двойную связь.
Различные группы бициклических терпенов обычно производят от углеводородов, не содержащих двойных связей, карана, пинана и камфана, которые, кроме шестичленного цикла, содержат трех , четырех и пятичленные циклы. Соответственно, различают бициклические терпены групп карана, пинана и камфана.
При внимательном рассмотрении формул бициклических терпенов видно, что в построении их меньшего кольца принимает участие изопропильная группа Н3С–С–СН3, которая содержится также в ментане.
Наибольшее значение из бициклических терпенов имеет пинен, который относится к группе пинана.
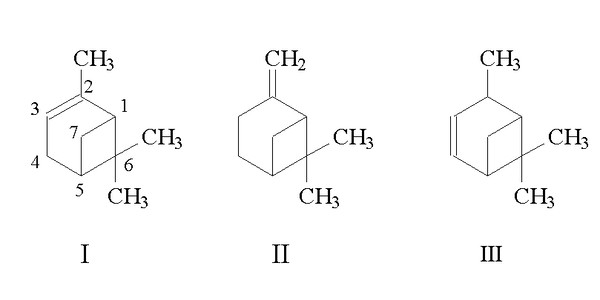
Пинен — главная составная часть скипидаров, или терпентинных масел, получаемых из хвойных растений. Название «пинен» произошло от латинского названия pinus — сосна.
Строение пинена — вещества высокореакционноспособного — установил русский ученый Е. Е. Вагнер. Чистый пинен — жидкость, обладающая запахом скипидара. Скипидар, или терпентинное масло, получается следующим образом. На коре хвойных деревьев (главным образом сосен) делают разрезы. Из этих разрезов вытекает жидкая смола, называемая также бальзамом или терпентином. Собранный жидкий терпентин, а также подсохшую смолу перегоняют с водяным паром, при этом отгоняются жидкие вещества смолы. Полученный отгон, отделенный от воды, и называется скипидаром, а остающаяся твердая смола — канифолью.
Существуют и другие способы получения скипидара, например экстрагирование его из измельченных пней растворителями (бензином).
В медицине применяется лишь наиболее чистый скипидар, полученный путем перегонки терпентина с водяным паром.
Скипидар, очищенный обработкой щелочью и перегонкой, состоит преимущественно из терпенов.
Скипидар нерастворим в воде, но смешивается в любых отношениях с рядом органических растворителей (эфиром, хлороформом, бензином).
Скипидар применяется в технике в качестве ценного растворителя. В медицине иногда применяют скипидар для втирания в кожу как раздражающее вещество при некоторых простудных заболеваниях.
Особенно важно значение скипидара или, точнее, содержащегося в нем пинена для синтеза камфары.
| 


