Сложные эфиры
Сложные эфиры – производные карбоновых кислот, которые можно рассматривать как результат замещения гидроксильной группы карбоновой кислоты на алкоксирадикал
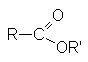
Методы получения сложных эфиров:
-
- Этерификация карбоновых кислот (см. химические свойства карбоновых кислот).
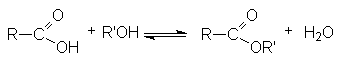
-
- Ацилирование спиртов галогенангидридами и ангидридами карбоновых кислот.
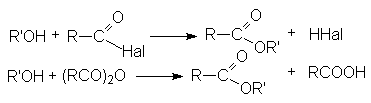
-
- Ацилирование алкоголятов галогенангидридами и ангидридами карбоновых кислот.
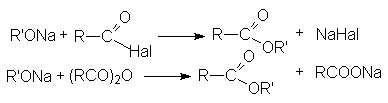
-
- Алкилирование солей карбоновых кислот.
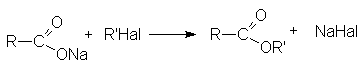
-
- Этерификация амидов и нитрилов карбоновых кислот.
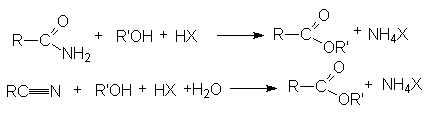
-
- Синтез метиловых эфиров взаимодействием карбоновых кислот с диазометаном.
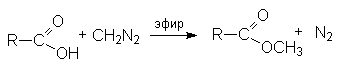
Механизм реакции:
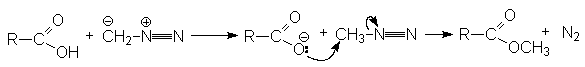
-
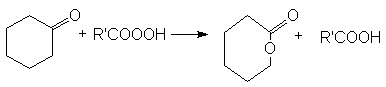
- Реакция Байера-Виллигера
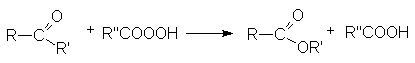
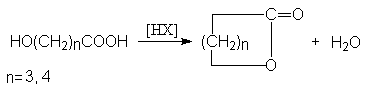
Методы синтеза лактонов (циклических сложных эфиров)
-
- Внутренняя этерификация γ - и δ -оксикарбоновых кислот.
-
- Реакция Байера-Виллигера
Физические свойства и строение сложных эфиров
Сложные эфиры являются бесцветными жидкостями или кристаллическими веществами с приятным запахом. Температура кипения сложных эфиров обычно ниже чем температура близких по молекулярной массе карбоновых кислот. Это свидетельствует об уменьшении межмолекулярных взаимодействий, что объясняется отсутствием межмолекулярных водородных связей.
Полярность связей в молекуле сложного эфира подобна полярности связи в карбоновых кислотах.
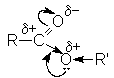
Основное отличие от карбоновых кислот – отсутствие подвижного протона, вместо него находится углеводородный остаток. Электрофильный центр находится на карбонильном и алкильном углеродном атоме. В то же время карбонильный кислород обладает основностью.
Химические свойства
Объектами нуклеофильной атаки могут быть ацильный или алкильный углерод. В то же время кислотность водородных атомов при α -углеродном атоме радикала кислоты обусловливает склонность сложность эфиров к реакции конденсации.
Реакции нуклеофильного замещения
-
- Гидролиз.
Различают кислотнокаталитический гидролиз и основной гидролиз (омыление). Кислотный гидролиз представляет собой обратимую реакцию.
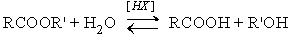
Механизм этой реакции – см в разделе Кислотно-каталитическая этерификация – Химические свойства карбоновых кислот.
Реакция омыления необратима. Основание не только ускоряет реакцию гидролиза, но выступает в качестве реагента. Эффективность реакции обусловлена высокой нуклеофильной активностью гидроксил-анионов.
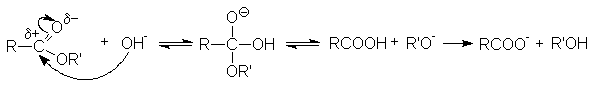
RCOOR' + NaOH → RCOONa + R'OH
-
- Аммонолиз.
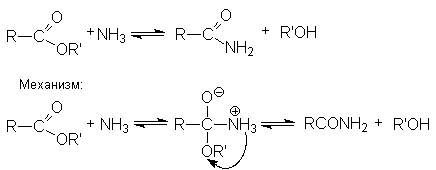
-
- Переэтерификация.
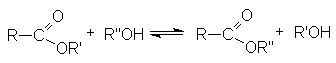
Реакция катализируется кислотами или основаниями.
-
- Взаимодействие с магний- и литий-органическими соединениями.
а) Реакция с магнийорганическими соединениями подобна реакции с галогенангидридами.
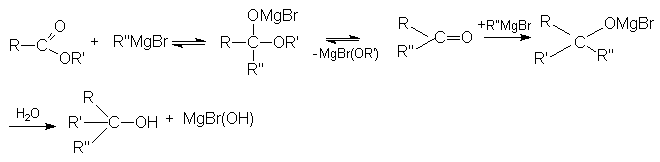
б) Взаимодействие с Li-органическими соединениями.
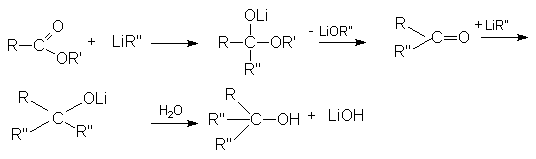
Реакции восстановления.
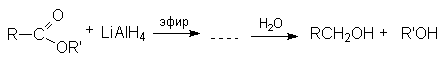
Реакции конденсации
Конденсация Кляйзена – наиболее важная в синтетическом отношении реакция. Ее стехиометрический результат заключается в автоконденсации этилацетата, катализируемая этилатом натрия.
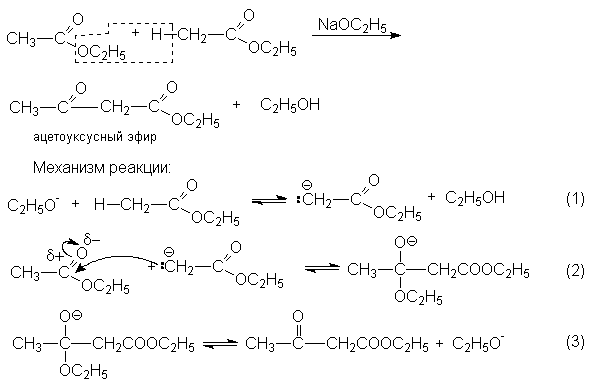
Условия равновесия неблагоприятны для всех трех стадий. Поэтому равновесие брутто-реакций существенно смещено в левую сторону.
Факторами смещения равновесия могут быть: отгонка этилового спирта, применение избытка этилата натрия. Последний метод оказывается эффективным, так как этанол более слабая кислота, чем енол сложного эфира, и избыток этилата смещает равновесие нацело вправо вследствие превращения β -кетоэфира в соль енола.



